Les rédacteurs de la loi du 1er juillet 1901 sur la liberté d’association n’avaient probablement pas en tête de réunir les victimes de la vieillesse et de la mort, comme Edgar Morin nous y incite avec humour. De grippes en canicules, elles nous rappellent que l’allongement de notre durée de vie est un progrès à double tranchant. Le vieillissement est autant un enjeu individuel qu’une cible d’action publique. La Direction de la Sécurité Sociale note par exemple avec intérêt que le contribuable moyen coûte en soin environ autant dans les 6 derniers mois de sa vie qu’entre sa naissance et le début de cette période. Suffit-il d’accompagner la vieillesse ou s’agit-il de la faire reculer ?
Repousser la vieillesse implique d’avoir des leviers particulièrement puissants. Sur fonds de fantasme lié à la quête d’immortalité1Laurent Alexandre, La mort de la mort (JC Lattès, 2011)., il est question ici d’explorer les exploits de la génétique et en premier lieu les technologies CRISPR. Elles atteignent des niveaux d’intervention sur le vivant tellement décisifs et précis qu’il est plus que jamais nécessaire de comprendre leurs réalités techniques, et d’en interroger les potentialités pour le « moins vieillir » comme pour le « bien vieillir ».
Les technologies CRISPR sont des machines biologiques dont la vocation selon ses concepteurs et ses porte-paroles est de vaincre les pathologies mortelles, repousser les facteurs de dégénérescence et enrayer les processus de vieillissement cellulaire (I). Leur introduction dans la société civile impose une prise de conscience des transformations anthropologiques associées à l’idée même de vieillissement (II).
Quand notre smartphone ne fonctionne plus, nous le mettons à jour. Quand les cellules de notre corps ne se comportent plus comme prévu, n’est-il pas temps de changer leur code source vers la dernière version ? La technique CRISPR-Cas9, utilisée à des fins de recherche sur l’être humain depuis 2016, permet d’éditer l’ADN. L’utopie technique qui alimente ce projet veut faire de l’exome, c’est-à-dire la partie codante de notre génome (soit 1,6% du total), un livre dont nous aurions la gomme et le crayon. De ce point de vue, le vieillissement ne serait plus un phénomène naturel à accompagner mais dans un premier temps une maladie chronique plurifactorielle à combattre, puis un processus dégénératif qu’il faudrait stopper et enfin un âge du sapiens actuel qu’il faudrait éliminer dès avant la naissance dans le futur. La guerre contre les effets de la vieillesse serait ainsi menée sur trois fronts.
COMBATTRE LES AFFECTIONS MORTELLES EST UN DES PREMIERS POTENTIELS DES TECHNOLOGIES CRISPR
En faisant un rapide panorama des projets de recherches en cours au niveau mondial, on remarque que, si la lutte contre les maladies génétiques se poursuit, de très nombreux projets ont pour but de vaincre unes à unes les grandes pathologies augmentant la mortalité. Sur plusieurs centaines d’études utilisant le CRISPR publiées entre aout 2016 et septembre 2017, un grand nombre concerne directement les cancers. L’intérêt de la technique pour leur traitement ne fait plus débat2CHEN, Si, SUN, Heng, MIAO, Ka i& al. CRISPR-Cas9: from Genome Editing to Cancer Research. Int J Biol Sci. 2016 ; 12 (12) : 1427–1436. Publié en ligne le 4 novembre 2016 – DOI : 10.7150/ijbs.1742, et elle continue de se déployer3MEYERS Robin M, BRYAN Jordan G, McFARLAND James M & al, Computational correction of copy number effect improves specificity of CRISPR–Cas9 essentiality screens in cancer cells, Nature Genetics, Publié en ligne le 30 Octobre 2017 DOI : 10.1038/ng.3984.
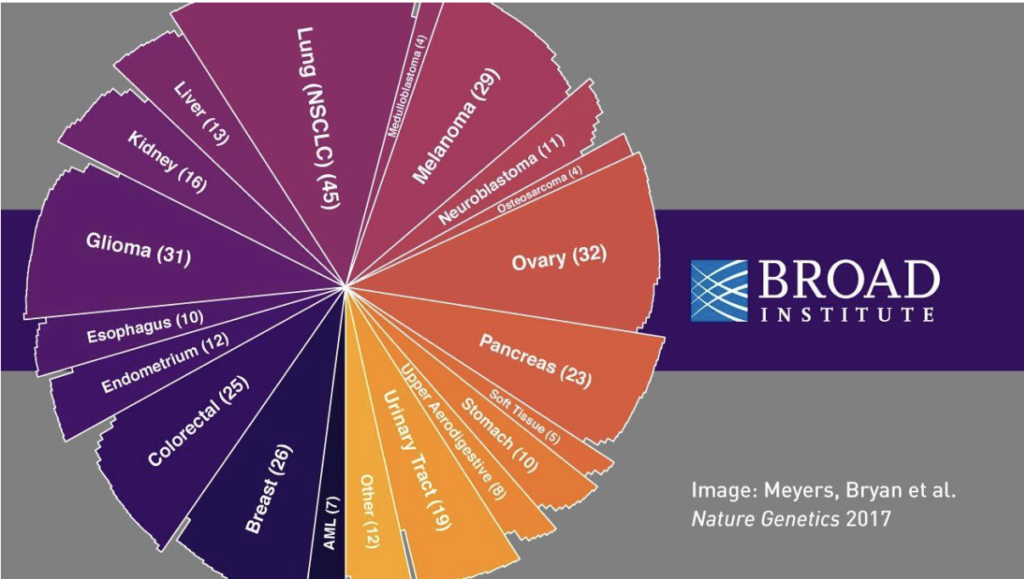
La plupart des cancers sont concernés : colon4YIN, Yan et al. TRIM11, a direct target of miR24-3p, promotes cell proliferation and inhibits apoptosis in colon cancer. Oncotarget (2016) DOI : 10.18632/oncotarget.13550, prostate5YE, Ruisong, PI, Min, COX, John V. & al. CRISPR/Cas9 targeting of GPRC6A suppresses prostate cancer tumorigenesis in a human xenograft model. Journal of Experimental & Clinical Cancer Research (2017). DOI : 10.1186/s13046- 017-0561-x, sein6HARROD, A et al. Genomic modelling of the ESR1 Y537S mutation for evaluating function and new therapeutic approaches for metastatic breast cancer. Oncogene (2016) DOI : 10.1038/ onc.2016.382, pancréas7HE, Yun et al. High Rab11-FIP4 expression predicts poor prognosis and exhibits tumor promotion in pancreatic cancer. International Journal of Oncology (2016) DOI :10.3892/ijo.2016.3828, foie8BO Zhu et al. Knockout of the Nogo-B Gene Attenuates Tumor Growth and Metastasis in Hepatocellular Carcinoma 1. Neoplasia (2017) DOI : 10.1016/j.neo.2017.02.007, ou encore ostéosarcome9LIAO, Yunfei et al. Targeting programmed cell death ligand 1 by CRISPR/Cas9 in osteosarcoma cells. Oncotarget (2017) DOI : 10.18632/oncotarget.16326. Ces travaux, s’ils portent leurs fruits, auront un impact sur l’espérance de vie. D’une part, les individus atteints de maladies génétiques lourdes parviendront à atteindre un âge avancé ; d’autre part, la vieillesse sera prolongée puisque suite à la diminution des affections mortelles.
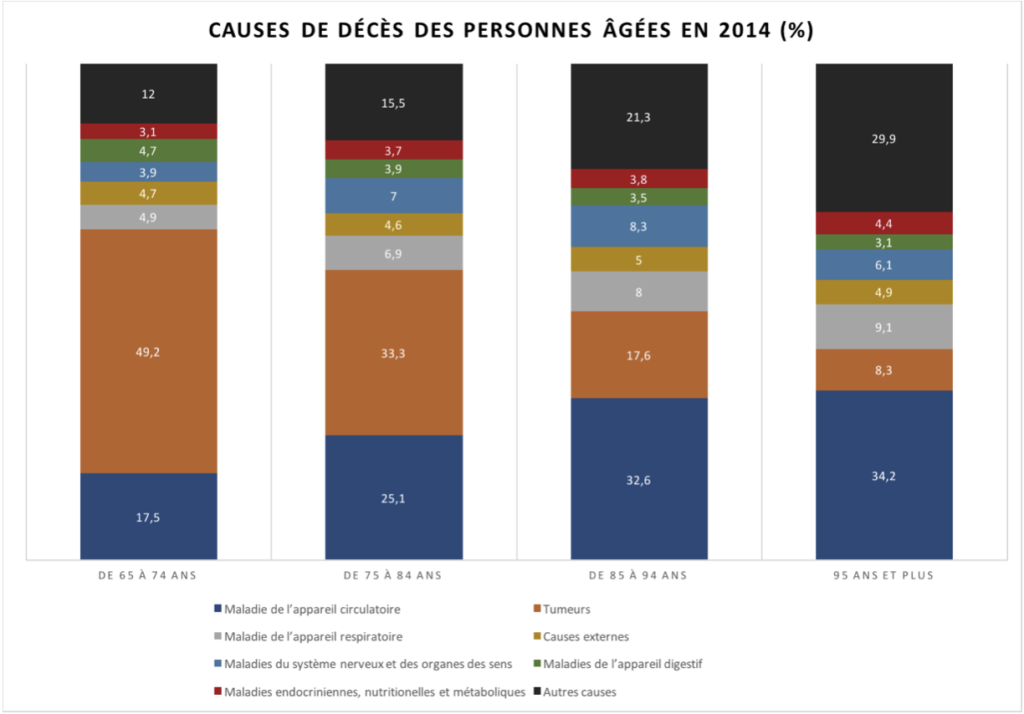
Les maladies cardiovasculaire et tumeurs sont de loin les deux principales causes de mortalité de 65 à 95 ans. Apporter des réponses à ces deux préoccupations devrait en théorie retarder la mort. C’est en tous cas la thèse de Yuval Noah Harari10Y. N. Harari in Homo Deus : Une brève histoire de l’avenir, Albin Michel 2017, p. 34 :
« Les humains meurent toujours des suites d’un pépin technique. Le cœur cesse de pomper le sang. Des dépôts de graisse bouchent l’artère principale. Des cellules cancéreuses se répandent dans le foie. Les germes se multiplient dans les poumons. Et qu’est-ce qui est responsable de tous ces problèmes techniques ? D’autres problèmes techniques. […] Rien de métaphysique dans tout cela. Uniquement des problèmes techniques. / Et tout problème technique a une solution technique. […] Nous pouvons tuer les cellules cancéreuses par la chimiothérapie ou des nanorobots. Nous pouvons exterminer les germes de nos poumons par des antibiotiques. Si le cœur s’arrête, nous pouvons le ranimer par des médicaments ou des électrochocs – et si ça ne marche pas, on peut implanter un nouveau cœur. »
Cette voie laisse encore de la place à l’Amicale invoquée par Edgar Morin. Henri Michaux la met en scène avec humour dès 1952 dans son texte d’anticipation Nouvelles de l’Étranger11H. Michaux : “Nouvelles de l’étranger” 1952, in Face aux verrous, Gallimard 1967, p.170 : « Certes, la durée de la vie humaine est chez nous bien augmentée mais le ralentissement des réflexes avec l’âge reste préoccupant. / Nos vieillards, nous les prolongeons aisément jusqu’à deux cents, deux cent cinquante ans, mais ils se font presque tous écraser dans la rue à cent trente ou cent quarante ». Nonobstant l’ironie de Michaux, on peut faire un rapide calcul. L’espérance de vie de l’être humain de 1870 était inférieure à 30 ans. Celle de l’humain de 2020 tend vers 72 ans. Si on prolonge cette tendance, continue sur tous les continents (à l’exception de l’Afrique et de l’ex-URSS, qui ont connu des parcours plus accidentés), l’être humain de 2150 pourrait raisonnablement tabler sur une existence longue de plus de 100 ans, en moyenne.
Cette simple extrapolation présente cependant deux failles majeures. La première est que l’espérance de vie est « artificiellement basse », du fait d’un contexte mondial où seule une petite partie de la population mondiale dispose d’infrastructures de soin réactives et de thérapies permettant de faire face aux affections de longue durée. Si tous les pays du monde avaient des infrastructures de santé comparables à celles de l’Union Européenne, l’espérance de vie mondiale serait proche des 80 ans. La deuxième est que ces systèmes de santé sont difficilement soutenables à long terme, en particulier si l’on veut garantir aux personnes âgées un niveau et une qualité de vie au moins digne.
LA DEUXIÈME VOIE CONSISTE À TRAVAILLER SUR LES MALADIES QUALIFIÉES DE DÉGÉNÉRESCENTES
Dès 2016, de nombreuses équipes de chercheurs identifient avec une précision grandissante les locus sensibles de toutes sortes de maladies dégénérescentes (notamment neurologiques) qui accompagnent souvent le vieillissement. Les affections issues d’un comportement anormal de cellules, qu’il s’agisse d’éléments directement héréditaires ou de mutations, pourraient ainsi être corrigées par une intervention directe sur les allèles concernées.
La piste du CRISPR comme moyen de lutte contre les maladies neurodégénératives est éclairée par Martin Kampmann dans une note12KAMPANN, Martin. A CRISPR Approach to Neurodegenerative Diseases. Trends in Molecular Medicine (2017) DOI : 10.1016/j.molmed.2017.04.003 publiée en juin 2017 dans la revue Cell. L’enjeu majeur des maladies de ce type réside dans les différences observées de résilience entre différents neurones chez l’être humain. Comprendre les mécanismes de ce phénomène, et ses causes cellulaires, permettrait d’en limiter l’impact. Les études précédentes sur la maladie d’Alzheimer qui se focalisaient sur les ARN messagers issus de la transcription de l’ADN13WANG, X. et al. (2010) Functional genomics of brain aging and Alzheimer’s disease: focus on selective neuronal vulnerability. Curr. Genomics (2010) DOI : 10.2174/138920210793360943 auraient ainsi montré leurs limites. Certes, elles peuvent mettre en évidence des différences protéiques (issues de la traduction de l’ARNm) entre les cellules vulnérables et celles qui sont résilientes. Mais elles ne permettent pas de déterminer un lien de causalité suffisant pour guider une intervention.
Pouvoir travailler sur l’ADN, grâce au CRISPR, plutôt que sur l’ARN (plus fragile à gérer, conserver et analyser), s’est révéléparticulièrement précieux pour l’étude des neurones humains. En effet, ces derniers sont plus difficiles à mettre en culture que d’autres types cellules, étape dont le recours au CRISPR permet de se dispenser. Neutraliser ici à coup sûr un gène, plutôt qu’une de ses potentielles transcriptions (en moyenne un gène peut avoir entre 4 et 5 transcriptions en ARNm possibles), ouvre une perspective d’intervention thérapeutique.
Une équipe Danoise s’est emparée de la technologie pour l’appliquer à la maladie d’Alzheimer. Avec l’accord du Comité Scientifique pour la Région de la Capitale14“De Videnskabsetiske Komiteer for Region Hovedstaden” (protocol number H-4-2011-157), Copenhagen, Denmark, elle montre dans un article15POON Anna, SCHMID Benjamin, PIRES Carlota, & al. Generation of a gene-corrected isogenic control hiPSC line derived from a familial Alzheimer’s disease patient carrying a L150P mutation in presenilin 1. Stem Cell Research (2016) DOI : 10.1016/j.scr.2016.09.018. publié dans la revue Stem Cell Research qu’il est possible de prélever des cellules de peau d’un malade atteint d’Alzheimer familial et de les faire régresser en cellules souches puis d’en corriger via CRISPR/Cas9 le gène PSEN1 défectueux, ici porteur de la mutation L150P responsable/impliquée dans le développement d’Alzheimer (?). Ces cellules servent ensuite de références de contrôle pour observer le delta de comportement cellulaire entre cellules saines et cellules atteintes porteuses du même génome par ailleurs. Dans le même temps, plusieurs équipes de chercheurs se donnent pour but de modifier avec le CRISPR les mutations responsables de la dégénérescence rétinienne.
Les terrains d’interventionthérapeutiquesdel’édition du génome sont nombreux et augmentent régulièrement. Mais comment déterminer le moment auquel on doit commencer à lutter contre le vieillissement ? La maturité sexuelle ? La fin du développement osseux ? Avant la fin de la fertilité ? Avant que la production d’hormone ne redescende ? Peut-on sélectionner certains aspects delaluttecontrelevieillissementetpasd’autres? Est-ce une priorité de lutter contre le blanchissement des cheveux quand on peut se les teindre ?
TROISIÈME FRONT : LE REMPLACEMENT D’UNE ATTENTE RÉSIGNÉE PAR UNE ANTICIPATION ACTIVE
George Church, généticien à Harvard et au MIT, développe des thérapies basées sur la technologie CRISPR-Cas9. Selon lui, la limite entre le rétablissement d’une situation antérieure et l’augmentation devient particulièrement floue lorsqu’il s’agit de lutter contre les effets de l’âge. Jean-François Mattei, ancien directeur du département de génétique du CHU de Marseille, député et ministre de la santé, précise dans son livre16J.-F. Mattei in Questions de conscience: De la génétique au posthumanisme, Les Liens qui Libèrent 2017, p. 132 que « le généticien George Church veut améliorer le génome en utilisant la méthode CRISPR-Cas9 et présente la liste des variants d’une dizaine de gène susceptibles de conférer aux personnes qui en seraient porteuses des caractéristiqueshors normes ou une résistance exceptionnelle à la maladie. […] Il conclut que la modification des gènes atteindra bientôt l’état où elle sera utilisée pour doter les personnes de versions améliorées des gènes. » Cette échelle serait cependant propre à chaque individu. La complexité du débat sur la nature de la santé, illustrée par Canguilhem17Georges Canguilhem, La santé, concept vulgaire et question philosophique (Pin-Balma: Sables, 1998). au siècle dernier, se trouve ainsi réouverte avec force. Quelle est la référence pour déterminer la « bonne santé » ? Est-ce une définition matérielle, fonctionnelle, basée sur la capacité de l’individu à réaliser certaines actions physiques ou mentales ? Ou devrait-elle être organique, basée sur l’efficacité des processus métaboliques par rapport à une moyenne observée sur la durée d’une vie ? On voit apparaitre des manières inédites d’approcher ces questions. Ainsi Michel Snyder, généticien à l’Université de Stanford, explique18SNYDER, Michel (2016) Médecine personnalisée : le décodage génomique et autres profilages. Communication présentée au Colloque Wright pour la Science à Genève. Repéré à https://mediaserver.unige.ch/play/97866 récemment qu’il a commencé à établir une base de données afin de déterminer ce qu’être en bonne santé signifie. À l’aide de séquençage génétique et de spectrométrie de masse, il analyse à intervalle régulier la composition de la flore bactérienne présente dans ses selles et dans son mucus nosocomial. Cette analysedure aujourd’hui depuis 7 ans, et ses résultats ne seront évidemment qu’une petite partie de la réponse recherchée. Incapables d’avoir une définition suffisante de la santé, nous sommes encore loin d’établir un référentiel stable à partir duquel éditer le génome.
Réparer un défaut implique de l’identifier, de le qualifier comme tel, et de lui opposer une version idéale, ou du moins fonctionnelle dela façon attendue. C’est un débat est bien connu en pharmacologie. L’établissement des standards de numération, par exemple les fourchettes de référence inscrites sur les résultats des prises de sang, sont aussi problématiques. Sans avoir à définir « d’humanité parfaite », l’application de l’édition du génomehumain va cependant entraîner un raffinement dedéfinition des degrés d’imperfection. S’il s’avère que le syndrome d’Asperger, une des variantes de ce groupe encore flou et hétérogène que l’on qualifie « d’autisme », est au moins partiellement d’origine génétique, faut-il pour autant le guérir ? Si les médias ont souvent surreprésenté le développement d’une compétence exceptionnelle, comme dans le film de Barry Levinson Rain Man, il n’en reste pas moins qu’il peut émerger de ces « différences » une certaine capacité humaine à vivre dans un monde qui n’est pas accessible à la grande majorité des individus (monde où le langage mathématique ou la musique semblent avoir plus de place que le langage relationnel humain).
La principale difficulté de cette branche est en effet de bien discerner le but à atteindre. Annoncer comme objectif « possible » dans le champ biomédical la création d’un humain entièrement reprogrammé sur le plan génétique, qui pourrait vivre des centaines d’années, est encore difficile. La définition de différents degrés sera-t-elle possible ? Et qui la fera ? En termes génétiques,c’est considérer que telle allèle favorise l’apparition de telle condition ou maladie, laquelle diminue la durée ou la qualité de la vie de l’individu. Ces pistes peuvent toujours se révéler être des impasses. Les questions de l’épigénétique ou de l’influence des différents locus de l’introme, parmi de nombreuses autres, peuvent encore se révéler comme étant des obstacles insurmontables.
Améliorer les performances permettrait idéalement de ne plus avoir à entrer dans l’âge de la vieillesse, d’en arrêter les principaux processus avant qu’ils ne commencent. Où situer ce « commencement » ? Il faudrait probablement le situer dès la conception, partir de la « fabrication » d’un humain « durable », jamais vieux, qu’il soit mortel ou pas. Ce retournement de perspective est l’essence du projet transhumaniste.
Modifier le génome pour résoudre les pathologies issues du vieillissement corporel et cellulaire peut devenir un des enjeux les plus clivants des technologies CRISPR. La remise en cause de la progression lente mais stable de l’espérance de vie, déjà problématique en termes démographiques, a de graves implications en termes de politiques publiques. Allonger la vie en bonne santé et prolonger la fertilité seraient des solutions inespérées aux impasses vers lesquels nous tendons à long terme, Japon en tête. Une société de flamboyants retraités pourra sembler hypothéquer notre avenir commun. Si l’on se fie à la maxime selon laquelle « gouverner c’est prévoir », il est urgent de penser et construire la transition.
LA COMPLEXITÉ DES ENJEUX POSÉS PAR L’ÉDITION DU GÉNOME AUGMENTE À GRANDE VITESSE, ET EST ENCORE AMPLIFIÉE PAR DES PRESSIONS SOCIALES, ÉCONOMIQUES ET HISTORIQUES TYPIQUES DU XXIÈME SIÈCLE
La révolution de l’édition du génome sera portée par tous les cycles auto-amplificateurs du XXIème siècle. Elle se développe avec une telle vélocité que son introduction dans la société s’annonce fracassante. Rodolphe Barrangou, co-auteur de l’article19BARRANGOU Rodolphe, FREMAUX Christophe, DEVEAU Hélène & al. CRISPR Provides Acquired Resistance Against Viruses in Prokaryotes. Science (2007) DOI : 10.1126/ science.1138140 signant ce qui a été rétrospectivement nommé « la première révolution CRISPR », le résume ainsi20Citation extraite de la conférence Legrain organisée par l’Ecole Normale supérieure le 17 janvier 2017 : « Là, sur l’autoroute de la science, ça va tellement vite, ça va tellement loin, qu’on en est au hors-piste : les scientifiques sont des pilotes qui sont au-delà de la route, pas de bitume, les bornes de régulation viendront ensuite. On ne construit jamais les routes avec les bornes en premier. […] CRISPR ne change pas les problèmes qui sont à discuter, CRISPR change juste notre sens de l’urgence […]. » La mise en place scientifique de ces perspectives se fait à très grande vitesse, entrainée par une compétition à grande échelle et des intérêts qui se comptent en milliards.
La société CRISPR Therapeutics est capitalisée à elle seule à plus de 750 millions de dollars à la mi-2017, sans avoir prouvé la moindre capacité à produire aucun bénéfice. L’étude de ces techniques pour prolonger la vie permet de donner corps à un rêve nourri par quelques milliardaires américains, capables de déployer des moyens importants en un temps record. UC Berkeley, UC San Francisco et Stanford University ont ainsi rejoint le Biohub, une plateforme de laboratoires soutenue à hauteur de 600 millions dedollars par Priscilla Chan, pédiatre, et son mari Mark Zuckerberg, fondateur de Facebook. Une des premières bénéficiaires de cet espace sera Jennifer Doudna, la co-découvreuse du CRISPR/Cas9. Calico, la société de Google fondée pour lutter contre le vieillissement, est quant à elle composée de chercheurs en médecine, pharmaceutique, biologie de synthèse et génétique. La concurrence croissante sur ces domaines augmente la pression du résultat, ce qui met à l’épreuve les laboratoires de centres de recherche publics moins bien dotés et tous les systèmes de régulation actuellement existants.
Mais l’impact en termes de finances publiques risque d’être encore plus massif. Le slogan de la transition génomique sera-t-il « vivre plus pour cotiser plus »? Il est certain que la régénération du génome aura un coût social à équilibrer. Cette expression, qui parsème à la fois les rapports de la Banque Mondiale et les revues d’économétrie, fait écho aux fameuses analyse couts-bénéfices qui permettent d’évaluer l’impact agrégé de projets d’infrastructure. Si considérer la santé comme infrastructure n’a absolument rien de novateur, comme nous le rappellent les différentes alertes pandémiques à grands coups de H, de N et de nombrespremiers, y faire entrer le génome est moins évident. En effet, intervenir sur les trois niveaux thérapeutiques explorés en première partie soulève un problème économique massif, relevant probablement moins des CBA que des CGE (computable general equilibrium modèles d’équilibre général calculable), c’est à dire d’un impact sur l’économie dans son ensemble plutôt que sur une zone artificiellement isolée du reste du monde.
L’APPROCHE INSTITUTIONNELLE DE LA COMPLEXITÉ GÉNOMIQUE DOIT ORGANISER LA RENCONTRE ENTRE INSTANCES DE DÉCISION CAPABLES DE PRODUIRE UN DÉBAT ÉCLAIRÉ
En même temps qu’elle fête les 20 ans de la convention d’Oviedo sur les droits de l’Homme et la biomédecine, l’assemblée parlementaire du Conseil de l’Europe publie une recommandation21Recommandation 2115 Le recours aux nouvelles technologies génétiques chez les êtres humains adoptée par l’assemblée parlementaire du Conseil de l’Europe le 12 octobre 2017 après discussion du rapport de la commission des questions sociales, de la santé et du développement durable. Rapporteure : Mme Petra De Sutter. intitulée Le recours aux nouvelles technologies génétiques chez les êtres humains dans laquelle elle considère (au paragraphe 3) que : « La modification intentionnelle du génome humain franchirait des limites jugées éthiquement inviolables. » La France est liée par cette convention. Elle devra donc, si les Etats Généraux de la Bioéthique ont bien lieu en 2018, demander l’éclairage de la Cour Européenne des Droits de l’Homme sur cette question.
Les directions, agences et juridictions qui auront des avis à produire sur la question devront ainsi articuler une multiplicité de principes avant de les confronter au dé bat d’initiés, puis au débat public. Si l’on imagine bien le Conseil d’État se pencher sur la signification de l’atteinte à la dignité à l’ère génomique, et la Direction Générale du Trésor faire des projections sur les gains macroéconomiques de l’accroissement du taux de participation à l’emploi, le Comité Consultatif National d’Ethique, l’INSERM et l’Académie nationale de Médecine auront encore une certaine marge pour préciser leur ébauche de position, actuellement centrée sur les embryons et les cellules germinales. Le Parlement français estenavancesur ces questions. Par un rapport22« Les enjeux économiques, environnementaux, sanitaires et éthiques des biotechnologies à la lumière des nouvelles pistes de recherche Rapport d’information de M. Jean-Yves LE DÉAUT, député et Mme Catherine PROCACCIA, sénateur, fait au nom de l’Office parlementaire d’évaluation des choix scientifiques et technologiques », 14 avril 2017, https://www.senat.fr/notice-rapport/2016/r16-507-1-notice.html. de 2017, il propose la création d’un corps de gouvernance pour l’ingénierie génétique similaire au GIEC, le Groupement d’Experts Intergouvernemental sur l’Evolution du Climat.
La qualité du débat entre les différentes instances institutionnelles chargées de préparer le terrain avant de l’introduire dans la société civile sera donc fonction de leur capacité à assumer la complexité des enjeux. Les pays qui seront les premiers à permettre l’édition du génome à des fins thérapeutiques seront aussi les premiers à pouvoir les déployer à grande échelle. La relative facilité de leur exécution pose un risque d’impact. Si la Chine n’a pas encore les moyens, en termes d’infrastructures, de proposer un niveau moyen de soins à l’ensemble de sa population comparable à celui de la France, elle pourrait très vite déployer des infrastructures d’édition du génome et engranger une avance impossible à rattraper. De la même façon que Fyodorov23FYODOROV SN, AGRANOVSKY AA. Long term results of anterior radial keratotomy. J Ocular Therapy Surg (1982) ; 1 : 217-223 a massivement popularisé la chirurgie réfractive en URSS dans les années 1970, la Chine dispose d’une capacité légale, technique et médicale à mettre en place ce type de soin difficile à égaler. Avec 400 millions de patients potentiels répartis en une petite soixantaine d’ethnies, le retour sur expérience fait qu’à l’instar de la chirurgie esthétique en Thaïlande,Corée ou au Brésil, le français aille subir son intervention dans l’Empire duMilieu.
Dans le même temps, le risque d’uneinsertion mal maîtrisée pose un enjeu politique majeur, au-delà des débats parlementaires et prises de positions publiques. La régénérescence génétique doit-elle être vue comme un type de médecine à part entière ? N’est-ce au contraire qu’un type de thérapie disponible ou pas dans chaque spécialité, comme la neurologie ou l’oncologie précités ? Est-ce un droit accessible à tous ou un devoir moral, sinonlégal, envers la société, comme la vaccination ? Les « victimes de la vieillesse » pourront-elles dans un avenir proche faire valoir un droit opposable au soin génomique devant les juridictions concernées ?
Robert Shrimsley, directeur de la rédaction du Financial Times, l’écrit avec humourCitation précise traduite par l’auteur : “The precise age at which I will get old is something of a moving target” issue de l’article A few wrinkles in the ‘age tax’, publié en ligne par le journal Financial Times le 20 octobre 2017 25 Idem, p.171 : « L’âge précis auquel je deviendrai vieux a quelque chose d’une cible mouvante ». Il dénonce le « djihad contre les gériatres » que lancerait le ministre du budget Philip Hammond avec sa « taxe sur l’âge », lequel forcerait les britanniques à refuser de devenir vieux pour éviter l’injustice fiscale. Michaux l’annonçait : « le corps de volontaires de la Mort absorbe une grande partie de la population. Mourir avec simplicité, si c’est utile, dès que ce sera utile… ». Comme les autres grandes tendances structurantes du XXI° siècle, il se peut que ces nouvelles techniques nous engagent sur la voie de création d’inégalités plus grandes que jamais en ce qui concerne le droit de vivre plus ou moins longtemps. Mais en attendant que les différentes instances de la puissance publique aient pris toute la mesure de leur responsabilité face aux nouveaux problèmes qu’elle inaugure, l’édition du génome continue ses progrès chaque mois plus fulgurants. L’avènement rapide de la « bio-informatiques », qui permet d’évaluer de larges jeux de données ADN obtenus par le séquençage de populations à risque, couplés aux progrès du deep learning des solutions logicielles proposées par Google (Deepmind) et IBM (Watson), vont probablement provoquer de nouvelles avancées au moins partiellement inattendues. Quelle serait l’instance de veille susceptible d’en tenir compte ? Les institutions existantes sont-elles suffisantes ? Quels processus institutionnels seront capables d’intégrer ces découvertes en temps réel et d’orienter leur cadre?